Fosforilación oxidativa
Fosforilación Oxidativa
[edit]La mitocondria es uno de los organelos de doble membrana con funciones especializadas productoras de energía, esto es, nucleótidos reducidos para finalmente formar la moneda energética celular que es el ATP. La molécula de Adenosin 5’-trifosfato (ATP) se sintetiza en la membrana interna mitocondrial como paso ulterior a la cadena de transporte de electrones a través de la fosforilación oxidativa. Este proceso aprovecha el flujo de protones o fuerza protón motriz, procedentes por un diferencial electroquímico de H+, para producir ATP mediante el complejo V de la membrana interna mitocondrial. Junto con la fotosíntesis es uno de los procesos de transducción de energía más importantes de la biosfera.[1]
Fosforilación Oxidativa: Síntesis de ATP
[edit]La mitocondria, en su membrana interna, es el lugar de la cadena transportadora de electrones y de la fosforilación oxidativa,| El transporte electrónico mitocondrial y la fosforilación oxidativa son los mecanismos que utilizan los organismos aeróbicos para sintetizar ATP a partir de moléculas orgánicas reducidas.
La cadena de transporte de electrones previa a la fosforilación oxidativa posee transductores electrónicos ligados a la membrana: complejo I (NADH -Ubiquinona deshidrogenasa), complejo II (Succinato ubiquinona deshidrogenasa), complejo III (Ubiquinona-Citocromo c oxidasa) y complejo IV (Citocromo oxidasa). Éstos acoplan el flujo de electrónico a la creación de una diferencia de pH transmembrana, que produce un gradiente de carga y concentración (fuerza protón-motriz). La síntesis de ATP se realiza por el complejo V, ATP sintetasa, gracias a la energía resultante de este gradiente de electrones que bombea protones a través de la membrana*. Los transportadores de electrones o complejos enzimáticos respiratorios son moléculas capaces de aceptar o ceder electrones, y que se asociación a enzimas para catalizar los electrones de un compuesto a otro. Pueden ser:
- Coenzimas hidrosolubles (NAD+) y grupos prostéticos (FNM y FAD).
- Lípidos como la ubiquinona o coenzima Q.
- Proteínas, como los citocromos y las proteínas ferrosulfuriladas. Los diferentes grupos protéticos que poseen actúan como transportadores electrónicos y junto con las proteínas conforman los complejos del I al IV.
Nuevas visiones mecanísticas de este proceso han surgido a partir de análisis estructurales tridimensionales de la ATP sintetasa, cuyo mecanismo catalítico es inusual, y dos de los complejos enzimáticos respiratorios, citocromo bc1 y citocromo c oxidasa.[2]
Complejos transductores electrónicos de la cadena de transporte de electrones.
Síntesis de ATP : Complejo V
[edit]El 'complejo V, ATP sintetasa o ATP sintasa (también denominada ATPasa o FoF1 ATP sintetasa, es una turbina molecular formada por dos componentes Fo y F1 con funciones definidas. Este complejo consume la energía del gradiente de concentración de H+ originado en por la cadena de transporte de electrones, para la síntesis de ATP transformándola en energía química de los enlaces de ésta molécula. El flujo de protones fluye hacia el interior a favor del gradiente electroquímico gracias a un rotor ubicado en la membrana. Los protones entran a través una entrada abierta a un lado de la membrana y se une a las subunidades del rotor. Diversas enzimas hidrolizan ATP, pero el 95% del ATP sintetizado por nuestras células en condiciones aerobias, es generado sólo por la F0F1 ATP sintasa. También hay formación de ATP por fosforilación a nivel de sustrato como ocurre en la glucólisis.[3] Hay diferentes funciones para las ATPasas en función de la célula a la que pertenezcan. Esta función está determinada por la estructura y subcomponentes de la ATPasa. Estas se pueden dividir en tres grupos:
- F-ATPasas
- V-ATPasas
- P-ATPasas
Complejo ATP sintasa
[edit]El componente F1
[edit]Es el componente responsable de la síntesis de ATP. Es una estructura que sobresale en forma de pomo, unido a la base mediante otras proteínas. Es una proteína periférica de membrana. Está formada por sendas cadenas polipetídicas:α 3 β3 Υεδ. Las cadenas alfa y beta están alternadas en un anillo hexamérico y son miembros de la familia de las NTPasas, ambas unen nucleótidos, pero solo beta participa en la catálisis. Las cadenas y forman el tallo central de la estructura. En la catálisis cada subunidad beta adopta una diferente conformación debido a su asociación con . Cabe destacar que este componente asilado en forma solubilizada cataliza la hidrólisis de ATP y que en bacterias tiene la composición α 3 β3 Υδε.[4]
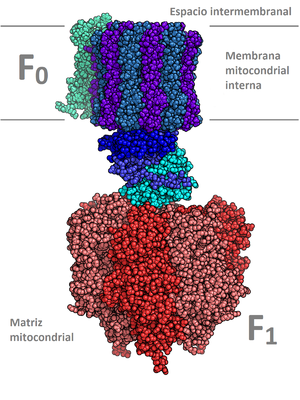
El componente F0
[edit]Es un canal protónico que acopla el paso de H+ a la formación de ATP. Es la base del pomo, una proteína integral de la membrana que transporta 3H+ por ATP sintetizado. Está formada por, 10-14 subunidades c y 1 subunidad a en la periferia del anillo. Este componente es sensible al antibiótico oligomiscina (de aquí deriva el O) y a la diciclihexilcarbodiimida, que impide la entrada de protones e inhibe la síntesis de ATP.
"Complejo V: Catálisis enzimática" La catálisis enzimática es de tipo rotacional entre tres centros de unión:
- T. Conformación de ATP: une con fuerza al ATP
- L. Conformación ADP: une débilmente ADP + Pi
- O.Conformación vacía: baja afinidad por ATP
La posición del eje central influye en la conformación y disposición de las subunidades vecinas que siguen una secuencia temporal de la rotación del eje central para formar ATP a partir de ADP.
Sistema rotor de la catálisis enzimática con tres sitios disponibles para la síntesis de ATP.[5]
Esta enzima puede funcionar en sentido contrario en presencia de ATP para hidrolizar el mismo cuando hay un gradiente de protones bajo que son bombeados a través de la membrana. La enzima se desplaza entre la forma firmemente el ATP y otra forma que desprende el ATP siempre que exista un gradiente de H+. Aunque la sintasa no precisa del gradiente de protones para generar ATP como se ha comprobado en experimentos de marcaje), pero por sí sola la ATP sintasa no es capaz de liberar este ATP al centro catalítico. La rotación del eje central se demostró gracias a la unión de un filamento de actina fluorescente a un unidad de ATPasaF1, el cual rotaba bajo el microscopio de fluorescencia. La G'º de la síntesis de ATP con una alta afinidad (Kd = 10-12 M) y ADP con una menor afinidad (Kd =10-5 M). De esta forma el equilibrio químico se desplaza a la síntesis hacia la formación de ATP.
Regulación de la fosforilación Oxidativa
[edit]El metabolismo celular es una maquinaria de autorregulación por la permanencia en la homeostasis, por este motivo es la demanda de energía celular la que regula el proceso de fosforilación oxidativa ya que el ATP se sintetiza sólo cuando es necesario para no desestabilizar otras rutas metabólicas.
A nivel de organelo, la mitocondria presenta una velocidad de respiración o consumo de O2 dependiente del sustrato ADP disponible para la fosforilación. Esta dependencia se llama control por aceptor de la respiración. Esto significa que a mayor concentración de ADP, mayor velocidad de síntesis de ATP y a su vez, la concentración de ADP está regulada por la ley de acción de masas y depende de las concentraciones de ATP y Pi en la matriz mitocondrial.
Debido a que el metabolismo celular es integrativo, procesos como la glucólisis, la beta oxidación de los ácidos grasos y la oxidación del acetilCoA en el ciclo de Krebs coordinan el control de la fosforilación oxidativa. Menor [ATP] implica mayor velocidad de estas rutas metabólicas; mayor [ATP] implica disminución de las mismas. Los efectores responsable de los anterior con el ATP, el ADP y el Pi.[6]
Otras consideraciones
[edit]Transporte activo de ATP, ADP y Pi
[edit]La membrana mitocondrial interna es impermeable al ADP, ATP y Pi. Estas moléculas entran por dos sistemas de transporte activo acoplados y que están influenciados por la fuerza protón motriz. Translocasa de adenina nucleótido Translocasa de fosfato
Estequiometría del consumo de oxígeno y síntesis de ATP
[edit]La fosforilación oxidativa presenta una ecuación que incluye a los nucleótidos reducidos puesto que la síntesis de ATP está acoplada a la oxidación de NADH u otros compuestos orgánicos reducidos:
O2 + 2NADH + H+. + 2Pi + ADP → x H2O + NAD+. + ATP
X es un número entero que indica la relación de ADP fosforilados por átomos de oxígeno reducidos. Esta relación P:O es complicada porque en la mitocondria se consume ATP en otras reacciones y consume O2 fuera de la fosforilación oxidativa. Por cada ATP sintetizado la ATPasa transloca 3H+ y por su parte el transporte por Pi, ADP y ATP requiere un H+. El rendimiento neto consiste en 4H+ transportados por ATP sintetizado. Para el NADH se bombean 10H+ por lo que se forman (10H+/4) 2.5 ATP Para el FADH2 se bombean 6H+ por lo que se forman (6H+/4) 1.5 ATP
Aporte protónico de la Cadena de Transporte de electrones a partir de NADH y FADH2.

Disipación de la energía libre de la CTE como calor
[edit]En animales hibernantes o mamíferos recién nacidos existe una excepción debido a la presencia de tejido adiposo café. La respiración no disminuye con el suministro de ATP. El tejido adiposo café contiene un elevado número de mitocondrias y cloroplastos. Estas mitocondrias poseen termogenina, una proteína de membrana interna. Los depósitos de grasa contienen triacilglicéridos (TAG) que son conducidos por lipólisis a ácidos grasos libres. Estos últimos activan la termogenina que a su vez desacopla la cadena de transporte electrónico (CTE) y la fosforilación oxidativas. La energía liberada por la CTE se disipa en forma de calor. En vegetales una oxidasa alternativa realiza un mecanismo similar.[7]
- ↑ https://books.google.com.mx/books?id=pQYm7IF7g7MC&pg=PA97&dq=diferencia+entre+atp+sintasa+y+sintetasa&hl=es&sa=X&ved=0ahUKEwiU-pj_g53KAhVI4SYKHRI_BZ0Q6AEIIDAB#v=onepage&q=diferencia%20entre%20atp%20sintasa%20y%20sintetasa&f=false
- ↑ Manjón et al. Guía de estudio para los Grados de Química y Bioquímica.UMU
- ↑ http://bq.unam.mx/wikidep/uploads/MensajeBioquimico/Mensaje_Bioq03v27p025_MTuena_10.pdf
- ↑ http://www.ecured.cu/ATP_Sintetasa
- ↑ http://www.ncbi.nlm.nih.gov/books/NBK21528/
- ↑ http://www.jbc.org/content/217/1/409.short
- ↑ Manjón et al. Guía de estudio para los Grados de Química y Bioquímica.UMU




